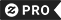Tippe / klicke auf das Bild, um weitere RealViews zu sehenTM
Die Lederdetails sind simuliert und werden als Farbe auf das Produkt gedruckt. Bei der Herstellung dieses Produktes wird kein Leder verwendet.Echte Folienprodukte durchsuchen
€ 2,15
pro Postkarte
I. IUPAC-Chemie-Nomenklatur Postkarte
Menge:
Papiertyp
Signature-Matt
18 pt Stärke / 120 lb Gewicht. Weichweiße, zarte Eierschalenstruktur.
-€ 0,20
Zuschreibung
Über Postcards
Verkauft von
Über dieses Design
Die Lederdetails sind simuliert und werden als Farbe auf das Produkt gedruckt. Bei der Herstellung dieses Produktes wird kein Leder verwendet.Echte Folienprodukte durchsuchen
I. IUPAC-Chemie-Nomenklatur Postkarte
Chemie (aus Arabisch: ك ي م ي ء Latinisiert: Chem (kēme), was "Wert" bedeutet, ist die Wissenschaft der Materie und die Veränderungen, die sie durchläuft. Die Wissenschaft der Materie wird auch von der Physik angegangen, aber während die Physik einen allgemeineren und grundlegenderen Ansatz verfolgt, ist die Chemie spezialisierter und befasst sich mit der Zusammensetzung, dem Verhalten, der Struktur und den Eigenschaften von Materie sowie mit den Veränderungen, die sie während chemischer Reaktionen durchläuft. Es ist eine physikalische Wissenschaft für Studien verschiedener Atome, Moleküle, Kristalle und anderer Aggregate der Materie, unabhängig oder kombiniert, die die Begriffe Energie und Entropie in Beziehung Spontaneität chemischer Prozesse. Die Disziplinen innerhalb der Chemie werden traditionell nach der Art der zu untersuchenden Materie oder der Art der Studie gruppiert. Dazu zählen die anorganische Chemie, die Untersuchung anorganischer Materie; Bio Chemie: Untersuchung Bio Materie; die Biochemie, die Untersuchung von Stoffen, die in biologischen Organismen gefunden werden; physikalische Chemie, energiebezogene Studien chemischer Systeme auf Makro-, Molekular- und Submolekularskala; analytische Chemie, die Analyse von Materialproben, um ein Verständnis ihrer chemischen Zusammensetzung und Struktur zu gewinnen. In den letzten Jahren haben sich viele spezialisierte Disziplinen entwickelt, z.B. die Neurochemie, die chemische Untersuchung des Nervensystems (siehe Subdisziplinen). Zusammenfassung Chemie ist die wissenschaftliche Untersuchung der Wechselwirkung chemischer Stoffe, die aus Atomen oder subatomaren Partikeln bestehen: Protonen, Elektronen und Neutronen. Atome bilden Moleküle oder Kristalle zusammen. Die Chemie wird oft als "Zentralwissenschaft" bezeichnet, weil sie die anderen Naturwissenschaften wie Astronomie, Physik, Materialwissenschaft, Biologie und Geologie miteinander verbindet. Die Entstehung der Chemie lässt sich auf bestimmte Praktiken zurückführen, die Alchemie genannt werden, die in verschiedenen Teilen der Welt, insbesondere im Nahen Osten, seit mehreren Jahrtausenden praktiziert wird. Die Struktur der Objekte, die wir gewöhnlich verwenden, und die Eigenschaften der Materie, mit der wir häufig interagieren, sind eine Folge der Eigenschaften chemischer Stoffe und ihrer Wechselwirkungen. Stahl beispielsweise ist härter als Eisen, weil seine Atome in einem starreren kristallinen Gitter zusammengebunden sind. Holz brennt oder wird schnell oxidiert, weil es spontan mit Sauerstoff in einer chemischen Reaktion oberhalb einer bestimmten Temperatur reagieren kann; Zucker und Salz lösen sich in Wasser auf, weil ihre molekularen/ionischen Eigenschaften so beschaffen sind, dass eine Auflösung unter den Umgebungsbedingungen bevorzugt wird. Die in der Chemie untersuchten Transformationen sind das Ergebnis von Wechselwirkungen zwischen verschiedenen chemischen Stoffen oder zwischen Materie und Energie. Die traditionelle Chemie umfasst die Untersuchung der Wechselwirkungen zwischen Stoffen in einem Chemielabor unter Verwendung verschiedener Formen von Laborglasware. Laboratorium, Institut für Biochemie von Köln Eine chemische Reaktion ist die Umwandlung einiger Stoffe in einen oder mehrere andere Stoffe. Sie kann symbolisch durch eine chemische Gleichung dargestellt werden. Die Anzahl der Atome auf der links und rechts in der Gleichung für eine chemische Umwandlung ist meistens gleich. Die Art der chemischen Reaktionen, denen ein Stoff ausgesetzt sein kann, und die Energieänderungen, die er begleiten kann, werden durch bestimmte als chemische Gesetze bekannte Grundregeln eingeschränkt. Energie und Entropie sind in fast allen chemischen Studien unweigerlich wichtig. Chemische Stoffe werden nach ihrer Struktur, Phase und chemischen Zusammensetzung klassifiziert. Sie können mithilfe chemischer Analysegeräte, z.B. Spektroskopie und Chromatographie, analysiert werden. Die Chemie ist ein integraler Bestandteil des Wissenschaftslehrplans, sowohl in der Oberstufe als auch in der Frühphase. Auf diesen Ebenen wird sie oft als "allgemeine Chemie" bezeichnet, die eine Einführung in eine Vielzahl grundlegender Konzepte darstellt, die es dem Studierenden ermöglichen, auf fortgeschrittenen Ebenen nützliche Werkzeuge und Fähigkeiten zu erwerben, wobei Chemie in allen seinen Unterbereichen unweigerlich studiert wird. Wissenschaftler, die in der chemischen Forschung verlobt sind, sind als Chemiker bekannt. Die meisten Chemiker sind auf eine oder mehrere Subdisziplinen spezialisiert. Geschichte Die alten Ägypter haben die Kunst der synthetischen "nassen" Chemie vor bis zu 4.000 Jahren als Pionier genutzt. Im Jahr 1000 v. Chr. setzten die alten Zivilisationen Technologien ein, die die Grundlage für die verschiedenen Bereiche der Chemie bildeten, wie z. B. Metallgewinnung aus ihren Erzen, Herstellung von Töpferwaren und Glasuren, Gärung von Bier und Wein, Herstellung von Pigmenten für Kosmetik und Malerei, Extraktion von Chemikalien aus Pflanze für Medizin und Parfum, Käseherstellung, sterbendes Tuch, Gerben von Leder, Fettumwandlung in Seife, Glasherstellung und Herstellung von Legierungen wie Bronze. Die Entstehung der Chemie lässt sich auf das weithin beobachtete Phänomen der Verbrennung zurückführen, das zur Metallurgie führte - die Kunst und Wissenschaft der Erzverarbeitung, um Metalle zu erhalten (z.B. Metallurgie im alten Indien). Die Gier nach Gold führte zur Entdeckung des Prozesses für seine Reinigung, obwohl die zugrunde liegenden Prinzipien nicht gut verstanden wurden - es galt als Transformation und nicht als Reinigung. Viele Wissenschaftler hielten es damals für vernünftig zu glauben, dass es Mittel gibt, um billigere (unedle) Metalle in Gold zu verwandeln. Dies gab der Alchemie Platz, und die Suche nach dem Stein des Weisen, der eine solche Transformation durch den reinen Atomismus der Touch herbeiführen sollte, geht auf das Jahr 440 v. Chr. zurück, wie das Buch De Rerum Natura (The Nature of Things) aus dem Roman Lucretiusin 50 v. Chr. zeigen könnte. Ein großer Teil der frühen Entwicklung von Reinigungsmethoden wird von Pliny dem Ältesten in seiner Naturalis Historia beschrieben. Eine vorläufige Kontur lautet: 1. Ägyptische Alchemie [3.000 v. u. Z. - 400 v. u. Z.], formulieren frühe "Element"-Theorien wie die Ogdoad. 2 Alchimie [332 v. u. Z. - 642 v. Chr.], der König Alexander der Große erobert Ägypten und gründet Alexandria, mit der weltgrößten Bibliothek, in der sich Wissenschaftler und weise Männer treffen, um zu studieren. 3. Arabische Alchemie [642 CE - 1200], die muslimische Eroberung Ägyptens (vor allem Alexandria); Die Entwicklung der wissenschaftlichen Methode durch Alhazen und Jābir ibn Hayyān revolutionieren den Bereich Chemie. 4. Das Haus der Weisheit (Arabisch: ب ي ت ا ح ك ل. Bait al-Hikma), Al-Andalus (Arabisch: ا ل أ ن ل سد und Alexandria (Arabisch: ا ل إ س ن دك ) werden zu den weltweit führenden Institutionen, in denen Wissenschaftler aller religiösen und ethnischen Hintergründe in einer Zeit, die als islamisches Goldenes Zeitalter bekannt ist, in Harmonie die Reichweite der Chemie ausbauten. 5. Jābir ibn Hayyān, al-Kindi, al-Razi, al-Biruni und Alhazen dominieren weiterhin das Gebiet der Chemie, beherrschen es und erweitern die Grenzen des Wissens und Experimentierens. 6. Europäische Alchemie [1300 - vorhanden], Pseudo-Geber baut auf arabischer Chemie auf. 7. Chemie [1661], schreibt Boyle seinen klassischen Chemietext The Skeptical Chymist. 8. Chemie [1787], schreibt Lavoisier seinen klassischen Elements of Chemistry. 9. Chemie [1803], Dalton veröffentlicht seine Atomtheorie. Die ersten Pioniere der Chemie und Erfinder der modernen wissenschaftlichen Methode waren mittelalterliche arabische und persische Gelehrte. Sie führten präzise Beobachtungen und kontrollierte Experimente in das Feld ein und entdeckten zahlreiche chemische Substanzen. Denn auf diesem Gebiet, wo die Griechen (soweit wir wissen) auf industrielle Erfahrung und vage Hypothesen beschränkt waren, führten die Sarazenen präzise Beobachtungen, kontrollierte Experimente und sorgfältige Platten ein. Sie erfanden und nannten die alembische (al-anbiq), chemisch analysiert unzählige Stoffe, bestehend aus Lapidarien, ausgeprägten Laugen und Säuren, untersuchten ihre Affinitäten, untersuchten und stellten hunderte von Medikamenten her. Die Alchimie, die die Muslime aus Ägypten geerbt haben, trug durch tausend nebensächliche Entdeckungen und durch ihre Methode, die die wissenschaftlichste aller mittelalterlichen Operationen war, zur Chemie bei." Die einflussreichsten muslimischen Chemiker waren Jābir ibn Hayyān (d. h. 815), al-Kindi (d. 873), al-Razi (d. 925), al-Biruni (d. 1048) und Alhazen (d. 1039). Die Werke von Jābir wurden in Europa durch lateinische Übersetzungen eines Pseudo-Geber im 14. Jahrhundert Spanien bekannt, der auch einige seiner eigenen Bücher unter dem Stift "Geber" schrieb. Auch der Beitrag der indischen Alchemisten und Metallurgen zur Entwicklung der Chemie war von großer Bedeutung. Das Entstehen der Chemie in Europa war in erster Linie auf das wiederkehrende Auftreten der Pest und der dort herrschenden Schrecken während des so genannten Dunklen Zeitalters zurückzuführen. Dies führte zu einem Bedarf an Medikamenten. Man dachte, es gäbe eine universelle Medizin namens Elixir of Life, die alle Krankheiten heilen kann, aber wie der Stein der Weisen wurde sie nie gefunden. Für einige Praktiker war Alchemie ein intellektuelles Streben, mit der Zeit got sie besser darin. Paracelsus (1493-1541) beispielsweise lehnte die 4-Elementartheorie ab und bildete mit nur einem vagen Verständnis seiner Chemikalien und Medikamente eine Mischung aus Alchemie und Wissenschaft in der so genannten Iatrochemie. In ähnlicher Weise führten die Einflüsse von Philosophen wie Sir Francis Bacon (1561-1626) und René Descartes (1596-1650), die mehr Strenge in der Mathematik verlangten und durch die Entfernung von Voreingenommenheit aus wissenschaftlichen Beobachtungen zu einer wissenschaftlichen Revolution. In der Chemie begann dies mit Robert Boyle (1627-1691), der eine Gleichung namens Boyle's Law über die Eigenschaften gasförmigen Staat entwickelte. Die Chemie entstand in der Tat, als Antoine Lavoisier (1743-1794), die Theorie der Erhaltung der Masse entwickelt, 1783; und die Entwicklung der Atomtheorie von John Dalton um 1800. Das Gesetz zur Erhaltung der Masse führte zur Neuformulierung der Chemie auf der Grundlage dieses Gesetzes und der Sauerstofftheorie der Verbrennung, die weitgehend auf der Arbeit von Lavoisier basierte. Lavoisiers fundamentale Beiträge zur Chemie waren das Ergebnis eines bewussten Bemühens, alle Experimente in den Rahmen einer Theorie des Single einzubinden. Er etablierte die konsequente Verwendung der chemischen Balance, nutzte Sauerstoff, um die Phlogiston-Theorie zu stürzen, entwickelte ein neues System der chemischen Nomenklatur und leistete einen Beitrag zum modernen metrischen System. Lavoisier arbeitete auch daran, die archaische und technische Sprache der Chemie in etwas zu übersetzen, das von den größtenteils ungebildeten Massen leicht verstanden werden konnte, was zu einem wachsenden öffentlichen Interesse an Chemie führte. All diese Fortschritte in der Chemie führten zu dem, was normalerweise als chemische Revolution bezeichnet wird. Die Beiträge von Lavoisier führten zu dem, was heute als moderne Chemie bezeichnet wird - der Chemie, die in Bildungseinrichtungen auf der ganzen Welt studiert wird. Aufgrund dieser und anderer Beiträge wird Antoine Lavoisier oft als "Vater der modernen Chemie" gefeiert.[18] Die spätere Entdeckung Friedrich Wöhlers, dass viele natürliche Stoffe, Bio Verbindungen, tatsächlich in einem Chemielabor synthetisiert werden können, hat auch der modernen Chemie geholfen, sich von ihren Anfängen zu erholen. Die Entdeckung der chemischen Elemente hat eine lange Geschichte aus den Tagen der Alchimie und gipfelt in der Entdeckung des Periodensystems der chemischen Elemente durch Dmitri Mendeleev (1834-1907) und späteren Entdeckungen einiger synthetischer Elemente. Hauptartikel zur Etymologie: Chemie (Ethyologie) Das Wort Chemie stammt aus der früheren Alchimieforschung, einem Set von Praxen, das Elemente der Chemie, Metallurgie, Philosophie, Astrologie, Astronomie, Mystik und Medizin umfasst. Alchimie wiederum leitet sich vom arabischen Wort "ك ي ي ء" ab, das "Wert" bedeutet, wird gemeinhin als Streben betrachtet, Blei oder ein anderes gemeinsames Ausgangsmaterial in Gold zu verwandeln.[21] Diese sprachliche Beziehung zwischen dem Streben nach Wert und Alchimie wird als ägyptische Ursprünge angenommen. Viele glauben, dass das arabische Wort "Alchimie" aus dem Wort Chemi oder Kimi abgeleitet ist, das der alte Name Ägyptens in Ägypten ist.[22][23][24] Das Wort wurde später von den Griechen geliehen und von den Griechen von den Arabern, als sie Alexandria (Ägypten) im 7. Jahrhundert besetzt hatten. Die Araber fügten dem Wort den arabischen definitiven Artikel "al" hinzu, was in dem Wort (al-kīmiyā) resultierte. So wurde ein Alchemist in der Volkssprache als "Chemiker" bezeichnet, und später wurde das Suffix "-ry" hinzugefügt, um die Kunst des Chemiker als "Chemie" zu beschreiben. Definitionen Im Nachhinein scheint sich die Definition von Chemie pro Jahrzehnt unweigerlich zu ändern, da neue Entdeckungen und Theorien die Funktionalität der Wissenschaft verstärken. Nachstehend sind einige der Standarddefinitionen aufgeführt, die von verschiedenen bekannten Chemikern verwendet werden: ・ Alchimie (330) - die Untersuchung der Zusammensetzung von Wasser, Bewegung, Wachstum, Prägung, Entprägung, zeichn der Spirituosen aus Körpern und Verklebung der Spirituosen im Körper (Zosimos). ・ Chymistry (1661) - das Thema der materiellen Prinzipien der Mimxkörper (Boyle). ・ Chymistry (1663) - eine wissenschaftliche Kunst, in der man lernt, Körper aufzulösen und von ihnen die verschiedenen Stoffe auf ihrer Zusammensetzung zeichnen, und sie wieder zu vereinen und sie einer höheren Perfektion auszusetzen (Glaser). ・ Chemie (1730) - die Kunst der Auflösung von Metallen, Verbindungen oder Aggregaten in ihren Prinzipien; und die Zusammensetzung dieser Gremien aus diesen Grundsätzen (Stahl). ・ Chemie (1837) - die Wissenschaft beschäftigte sich mit den Gesetzen und Wirkungen molekularer Kräfte (Dumas). ・ Chemie (1947) - Stoffforschung: ihre Struktur, ihre Eigenschaften und die Reaktionen, die sie in andere Stoffe umwandeln (Pauling). ・ Chemie (1998) - die Untersuchung der Materie und der Veränderungen, die sie durchläuft (Chang). Grundbegriffe Für das Studium der Chemie sind mehrere Konzepte unerlässlich. Einige davon sind: Hauptartikel: Atom Ein Atom ist die grundlegende Einheit der Chemie. Es besteht aus einem positiv geladenen Kern (dem Atomkern), der Protonen und Neutronen enthält und eine Anzahl von Elektronen unterhält, um die positive Ladung im Kern auszugleichen. Das Atom ist auch die kleinste Einheit, die in Betracht gezogen werden kann, um einige der chemischen Eigenschaften des Elements zu erhalten, wie z. B. Elektronik, Ionisierungspotenzial, bevorzugte Oxidationsmittel, Koordinationsnummer und bevorzugte Formen von Bindungen (z. B. metallisch, ionisch, kovalent). Element Hauptartikel: Chemisches Element Der Begriff des chemischen Elements steht im Zusammenhang mit dem Begriff des chemischen Stoffes. Ein chemisches Element ist durch eine bestimmte Anzahl von Protonen im Kern seiner Atome charakterisiert. Diese Zahl wird als die Atomnummer des Elements bezeichnet. Zum Beispiel sind alle Atome mit 6 Protonen in ihren Kernen Atome des chemischen Elements Kohlenstoff, und alle Atome mit 92 Protonen in ihren Kernen sind Atome des Elements Uran. 94 verschiedene chemische Elemente oder Arten von Atomen, basierend auf der Anzahl von Protonen, existieren natürlich. Weitere 18 wurden von der IUPAC als rein künstlich existierend anerkannt. Obwohl alle Kerne aller Atome, die zu einem Element gehören, die gleiche Anzahl von Protonen haben werden, haben sie vielleicht nicht unbedingt die gleiche Anzahl von Neutronen, solche Atome werden Isotope genannt. Tatsächlich können mehrere Isotope eines Elements existieren. Die bequemste Darstellung der chemischen Elemente findet sich in der Periodenabfrage der chemischen Elemente, die Elemente nach Atomnummer gruppiert. Aufgrund ihrer genialen Anordnung haben Gruppen oder Spalten sowie Zeiträume oder Zeilen von Elementen in der Tabelle entweder mehrere chemische Eigenschaften oder folgen einem bestimmten Trend in Merkmalen wie atomarem Radius, Elektronik usw. Listen der Elemente nach Namen, Symbolen und Atomnummern stehen ebenfalls zur Verfügung. Hauptartikel: Chemische Verbindung A ist ein Stoff mit einem bestimmten Verhältnis von Atomen bestimmter chemischer Elemente, der seine Zusammensetzung bestimmt, und einer bestimmten Organisation, die die chemischen Eigenschaften bestimmt. Zum Beispiel ist Wasser eine Verbindung, die Wasserstoff und Sauerstoff im Verhältnis von zwei zu eins enthält, mit dem Sauerstoffatom zwischen den beiden Wasserstoffatomen und einem Winkel von 104,5° zwischen ihnen. Durch chemische Reaktionen bilden sich Verbindungen und werden interkonvertiert. Stoff Hauptartikel: Chemische Substanz Eine chemische Substanz ist eine Substanz mit einer bestimmten Zusammensetzung und einem bestimmten Set von Eigenschaften.[33] Eine Mischung aus Verbindungen, Elementen oder Verbindungen und Elementen ist keine chemische Substanz, sondern kann als Chemikalie bezeichnet werden. Die meisten Stoffe, auf die wir in unserem täglichen Leben stoßen, sind eine Art Mischung. for example: Die Nomenklatur von Stoffen ist ein wesentlicher Bestandteil der Sprache der Chemie. Im Allgemeinen bezieht es sich auf ein System zur Bezeichnung chemischer Verbindungen. Früher in der Geschichte der chemischen Stoffe wurden von ihrem Entdecker benannt, was oft zu Verwirrung und Schwierigkeiten führte. Das IUPAC-System der chemischen Nomenklatur erlaubt es den Chemikern jedoch heute, namensspezifische Verbindungen unter den verschiedensten möglichen Chemikalien anzugeben. Die Standardnomenklatur chemischer Stoffe ist Set der Internationalen Gewerkschaft für reine und angewandte Chemie (IUPAC). Es gibt gut definierte Systeme für die Benennung chemischer Arten. Bio Verbindungen werden nach dem System der Bio Nomenklatur benannt.[34] Anorganische Verbindungen werden nach dem System der anorganischen Nomenklatur benannt.[35] Darüber hinaus hat der Abstrakte Dienst Chemie ein Verfahren zur Indizierung chemischer Stoffe entwickelt. In diesem Schema ist jeder chemische Stoff durch eine Zahl, die als CAS-Registernummer bezeichnet wird, identifizierbar. Hauptartikel: Molekül A ist neben einem Atom der kleinste unteilbare Teil einer reinen chemischen Substanz, die ihr einzigartiges Set chemischer Eigenschaften hat, d.h. ihr Potenzial, sich einem bestimmten Set chemischer Reaktionen mit anderen Stoffen zu unterziehen. Moleküle können im Gegensatz zu Ionen als elektrisch neutrale Einheiten existieren. Moleküle sind typischerweise ein Set von Atomen, die durch kovalente Bindungen miteinander verbunden sind, sodass die Struktur elektrisch neutral ist und alle Valenzelektronen entweder in Bindungen oder in Einzelpaaren miteinander verbunden sind. Eine molekulare Struktur zeigt die Verbindungen und relativen Positionen von Atomen in einem Molekül wie dem hier gezeigten Paclitaxel. Eines der Hauptmerkmale eines Moleküls ist seine Geometrie, die oft als Struktur bezeichnet wird. Während die Struktur von diatomischen, triatomischen oder tetra atomaren Molekülen trivial sein kann (linear, eckig pyramidal usw.), kann die Struktur polyatomarer Moleküle, die aus mehr als sechs Atomen (von mehreren Elementen) bestehen, für ihre chemische Beschaffenheit von entscheidender Bedeutung sein. Hauptartikel: Mole (Unit) Ein Mol ist die Menge einer Substanz, die so viele Elementarkörper (Atome, Moleküle oder Ionen) enthält wie Atome in 0,012 Kilogramm (oder 12 Gramm) Kohlenstoff-12, wo die Kohlenstoff-12-Atome ungebunden sind, bei Erholung und in ihrem Staat.[36] Diese Zahl ist bekannt als Avogadro-Konstante und wird bestimmt EUR. Der derzeit akzeptierte Wert beträgt 6,02214179(30) × 1023 mol-1 (CODATA 2007). Der beste Weg, die Bedeutung des Begriffs "Maulwurf" zu verstehen, besteht darin, ihn mit Begriffen wie Dutzend zu vergleichen. Genau wie ein Dutzend ist gleich 12, ist ein Mol gleich 6,02214179(30) × 1023. Der Begriff wird verwendet, weil es viel leichter zu sagen, zum Beispiel, 1 Mol Kohlenstoff-Atome, als es zu sagen 6,02214179(30) × 1023 Kohlenstoff-Atome. Genauso können wir die Anzahl der Einheiten als Vielfaches oder Bruchteil von 1 Mol beschreiben, z. B. 2 Mol oder 0,5 Mol. Mole ist eine absolute Zahl (ohne Einheiten) und kann jede Art von elementarem Objekt beschreiben, obwohl die Verwendung des Mol in der Regel auf die Messung von subatomaren, atomaren und molekularen Strukturen beschränkt ist. Die Anzahl der Molen eines Stoffes in einem Liter einer Lösung wird als ihre Molarität bezeichnet. Molarität ist die gängige Einheit, mit der die Konzentration einer Lösung in physikalischer Chemie ausgedrückt wird. Ionen und Salze Hauptprodukt: Ion Ein Ion ist eine geladene Spezies, ein Atom oder ein Molekül, das einen oder mehrere Elektronen verloren hat oder gewonnen hat. Positiv geladene Kationen (z. B. Natriumkation Na+) und negativ geladene Anionen (z. B. Chlorid-Cl-) können ein kristallines Gitter neutraler Salze (z. B. Natriumchlorid NaCl) bilden. Beispiele für Polyatomionen, die sich während der Säure-Base-Reaktionen nicht aufteilen, sind Hydroxid (OH-) und Phosphat (PO43-). Ionen in der gasförmigen Phase werden oft als Plasma bezeichnet. Säure und Basiseigenschaft Hauptartikel: Säure Ein Stoff kann oft als Säure oder Basen eingestuft werden. Dies geschieht oft auf der Grundlage einer bestimmten Reaktion, nämlich des Austauschs von Protonen zwischen chemischen Verbindungen. Der amerikanische Chemiker Gilbert Newton Lewis hat jedoch eine Ausweitung dieses Klassifizierungsmodus vorgenommen. In dieser Klassifizierungsart beschränkt sich die Reaktion nicht auf die Reaktion in einer wässrigen Lösung und ist somit nicht mehr auf Lösungen in Wasser beschränkt. Nach dem Konzept gemäß Lewis sind die wichtigsten Dinge, die ausgetauscht werden, Vorwürfe Es gibt mehrere andere Möglichkeiten, wie ein Stoff als Säure oder Basis eingestuft werden kann, wie in der Geschichte dieses Konzepts Phase Hauptartikel: Phase (Materie) Zusätzlich zu den spezifischen chemischen Eigenschaften, die unterschiedliche chemische Einstufungen unterscheiden, können Chemikalien in mehreren Phasen bestehen. Die chemischen Einstufungen sind größtenteils unabhängig von diesen Einstufungen der Massengutphase; Allerdings sind einige exotische Phasen mit bestimmten chemischen Eigenschaften unvereinbar. Eine Phase ist ein Set von Staaten eines chemischen Systems, die über eine Reihe von Bedingungen, wie z. B. Druck oder Temperatur, ähnliche Massenstöcke aufweisen. Physikalische Eigenschaften wie Dichte und Brechungsindex fallen tendenziell innerhalb der Werte ab, die für die Phase charakteristisch sind. Die Phase der Materie wird durch den Phasenübergang definiert, d. h., wenn die in das System eingeführte oder aus dem System genommene Energie in die Umgestaltung der Systemstruktur fließt, anstatt die Gesamtbedingungen zu ändern. Manchmal kann die Unterscheidung zwischen Phasen durchgängig sein, anstatt eine diskrete Grenze zu haben, in diesem Fall wird die Angelegenheit als in einem superkritischen Staat betrachtet. Wenn drei Staaten auf der Grundlage der Bedingungen, ist es als Triple Point bekannt und da dies unveränderlich ist, ist es eine bequeme Möglichkeit, ein Set von Bedingungen zu definieren. Die bekanntesten Beispiele für Phasen sind Feststoffe, Flüssigkeiten und Gase. Viele Stoffe weisen mehrere feste Phasen auf. So gibt es beispielsweise drei Phasen aus festem Eisen (alpha, gamma und delta), die je nach Temperatur und Druck variieren. Ein Hauptunterschied zwischen den festen Phasen ist die Kristallstruktur oder Anordnung der Atome. Eine weitere bei der Untersuchung der Chemie häufig auftretende Phase ist die Wasserphase, d. h. der Staat von Stoffen, die in wässriger Lösung (d. h. in Wasser) gelöst werden. Weniger bekannte Phasen sind Plasmas, Bose-Einstein-Kondensate und Fermionkondensate sowie die paramagnetischen und ferromagnetischen Phasen magnetischer Materialien. Während sich die meisten bekannten Phasen mit dreidimensionalen Systemen befassen, ist es auch möglich, Analoga in zweidimensionalen Systemen zu definieren, die Aufmerksamkeit auf ihre Relevanz für Systeme in der Biologie erhalten haben. Redox Hauptartikel: Redox Es ist ein Konzept in Bezug auf die Fähigkeit von Atomen verschiedener Stoffe zu verlieren oder zu gewinnen Elektronen. Stoffe, die andere Stoffe oxidieren können, gelten als oxidativ und werden als oxidierende Agent, Oxidantien oder Oxidationsmittel bezeichnet. Ein Oxidationsmittel entfernt Elektronen von einer anderen Substanz. In ähnlicher Weise gelten Stoffe, die andere Stoffe reduzieren können, als reduktiv und als Reduktionsmittel für Agent, Reduktionsmittel oder Reduktionsmittel bekannt. Ein Reduktionsmittel überträgt Elektronen in eine andere Substanz und wird so selbst oxidiert. Und weil es Elektronen "spendet", wird es auch Elektronenspender genannt. Oxidation und Reduktion beziehen sich in der Regel auf eine Änderung der Oxidationszahl - die tatsächliche Übertragung von Elektronen kann niemals eintreten. Daher ist Oxidation besser definiert als Erhöhung der Oxidationszahl und Reduktion als Verringerung der Oxidationszahl. Es wird behauptet, dass Atome, die in Molekülen oder Kristallen zusammenkleben, miteinander verbunden sind. Eine chemische Bindung kann als Multiplikationsgleichgewicht zwischen den positiven Ladungen im Kern und den negativen Ladungen visualisiert werden, die über sie oszillieren. Mehr als nur Attraktion und Repulsion charakterisieren die Energien und Verteilungen die Verfügbarkeit eines Elektrons zur Bindung an ein anderes Atom. Eine chemische Bindung kann entweder eine kovalente Bindung, eine ionische Bindung, eine Wasserstoffbindung oder einfach nur wegen der Van der Waals-Kraft sein. Jede dieser Bindungen ist einem gewissen Potenzial zuzuschreiben. Diese Potenziale erzeugen die Wechselwirkungen, die Atome in Molekülen oder Kristallen zusammenhalten. In vielen einfachen Verbindungen, der Valence Bond Theory, dem Valence Muschel Electron Pair Repulsion Model (VSEPR) und dem Begriff der Oxidationszahl kann verwendet werden, um molekulare Struktur und Zusammensetzung zu erklären. In ähnlicher Weise können Theorien aus der klassischen Physik genutzt werden, um viele ionische Strukturen vorherzusagen. Bei komplizierteren Verbindungen, wie etwa Metallkomplexen, ist die Theorie der Valenzbindung weniger anwendbar, und alternative Ansätze wie die molekulare Orbitaltheorie werden im Allgemeinen verwendet. Siehe Diagramm zu elektronischen Orbitalen. Hauptartikel: Chemische Reaktion Wenn eine chemische Substanz infolge ihrer Wechselwirkung mit einer anderen oder einer anderen Energie umgewandelt wird, soll eine chemische Reaktion aufgetreten sein. Die chemische Reaktion ist daher ein Begriff, der sich auf die "Reaktion" eines Stoffes bezieht, wenn er nah mit einem anderen in Berührung kommt, sei es als Gemisch oder als Lösung; Exposition gegenüber einer bestimmten Form von Energie, oder beides. Es führt zu einem gewissen Energieaustausch zwischen den Bestandteilen der Reaktion sowie mit der Systemumgebung, bei der es sich um entworfene Gefäße handeln kann, die häufig Laborglasware sind. Chemische Reaktionen können zur Bildung oder Trennung von Molekülen führen, d. h. Moleküle, die auseinanderbrechen, um zwei oder mehr kleinere Moleküle zu bilden, oder die Neuordnung von Atomen innerhalb oder zwischen Molekülen. Chemische Reaktionen beinhalten in der Regel die Herstellung oder das Zerbrechen chemischer Bindungen. Oxidation, Reduktion, Dissoziation, Säureneutralisierung und molekulare Neuordnung sind einige der gebräuchlichen chemischen Reaktionen. Eine chemische Reaktion kann durch eine chemische Gleichung symbolisch dargestellt werden. Während in einer nicht nuklearen chemischen Reaktion die Anzahl und die Art der Atome auf beiden Seiten der Gleichung gleich sind, gilt dies für eine nukleare Reaktion nur für die nuklearen Teilchen, nämlich Protonen und Neutronen. Die Reihenfolge der Schritte, in denen die Reorganisation chemischer Bindungen im Verlauf einer chemischen Reaktion stattfinden kann, wird als ihr Mechanismus bezeichnet. Eine chemische Reaktion kann in einer Reihe von Schritten erfolgen, von denen jeder eine andere Geschwindigkeit haben kann. Viele Reaktionsvermittler mit variabler Stabilität können daher im Verlauf einer Reaktion ins Auge gefasst werden. Es werden Reaktionsmechanismen vorgeschlagen, um die Kinetik und den relativen Produktmix einer Reaktion zu erklären. Viele physikalische Chemiker sind darauf spezialisiert, die Mechanismen verschiedener chemischer Reaktionen zu erforschen und vorzuschlagen. Mehrere empirische Regeln, wie die Woodward-Hoffmann-Regeln, sind oft nützlich, wenn sie einen Mechanismus für eine chemische Reaktion vorschlagen. Nach dem Goldbuch der IUPAC ist eine chemische Reaktion ein Prozess, der zur Umwandlung chemischer Arten führt." Dementsprechend kann eine chemische Reaktion eine Elementarreaktion oder eine schrittweise Reaktion sein. Ein weiterer Vorbehalt besteht darin, dass diese Begriffsbestimmung Hüllen umfasst, bei denen die Umwandlung von Konformern experimentell erkennbar ist. Solche nachweisbaren chemischen Reaktionen beinhalten normalerweise Sets molekularer Einheiten, wie in dieser Definition angegeben, aber es ist oft konzeptionell bequem, den Begriff auch für Veränderungen zu verwenden, die molekulare Single betreffen (z. "mikroskopische chemische Ereignisse"). Equilibrium Hauptartikel: Chemisches Gleichgewicht Obwohl der Begriff des Gleichgewichts in den Wissenschaften weit verbreitet ist, im Kontext der Chemie, entsteht er immer dann, wenn verschiedene Staaten der chemischen Zusammensetzung möglich sind. Zum Beispiel in einer Mischung aus mehreren chemischen Verbindungen, die miteinander reagieren können, oder wenn ein Stoff in mehreren Phasen vorhanden sein kann. Ein System chemischer Stoffe, das sich im Gleichgewicht befindet, obwohl es eine unveränderliche Zusammensetzung aufweist, ist meistens nicht statisch; Moleküle der Stoffe reagieren weiterhin miteinander, wodurch ein dynamisches Gleichgewicht entsteht. So beschreibt das Konzept den Staat, in dem die Parameter wie die chemische Zusammensetzung im Laufe der Zeit unverändert bleiben. Chemikalien, die in biologischen Systemen vorhanden sind, befinden sich unweigerlich nicht im Gleichgewicht, sondern sind weit von einem Gleichgewicht entfernt. Energie Hauptartikel: Energie Im Kontext der Chemie ist Energie ein Attribut eines Stoffes als Folge seiner atomaren, molekularen oder aggregierten Struktur. Da eine chemische Umwandlung von einer Änderung einer oder mehrerer dieser Arten von Struktur begleitet wird, geht sie zwangsläufig mit einer Erhöhung oder Verringerung der Energie der betreffenden Stoffe einher. Ein Teil der Energie wird zwischen der Umgebung und den Reaktanten der Reaktion in Form von Wärme oder Licht übertragen; so können die Produkte einer Reaktion mehr oder weniger Energie haben als die Reaktoren. Eine Reaktion gilt als exergonisch, wenn der endgültige Staat auf der Energiebilanz niedriger ist als der ursprüngliche Staat. bei endergonischen Reaktionen ist die Situation umgekehrt. Eine Reaktion gilt als exotherm, wenn die Reaktion Wärme in die Umgebung freisetzt. bei endothermen Reaktionen absorbiert die Reaktion Wärme aus der Umgebung. Chemische Reaktionen sind unweigerlich nur möglich, wenn die Reaktanten eine Energieschranke, die so genannte Aktivierungsenergie, überwinden. Die Geschwindigkeit einer chemischen Reaktion (bei einer gegebenen Temperatur T) hängt mit der Aktivierungsenergie E zusammen, mit dem Bevölkerungsfaktor e - E / kT - des Boltzmanns, d. h. der Wahrscheinlichkeit, dass die Moleküle bei der gegebenen Temperatur T Energie größer oder gleich E haben. Diese exponentielle Abhängigkeit einer Reaktionsgeschwindigkeit von der Temperatur wird als Arrhenius-Gleichung bezeichnet. Die für eine chemische Reaktion erforderliche Aktivierungsenergie kann in Form von Wärme, Licht, Strom oder mechanischer Kraft in Form von Ultraschall erfolgen. Ein damit verbundenes Konzept der freien Energie, das auch Überlegungen zur Entropie enthält, ist ein sehr nützliches Mittel, um die Machbarkeit einer Reaktion vorherzusagen und den Staat des Gleichgewichts einer chemischen Reaktion in der chemischen Thermodynamik zu bestimmen. Eine Reaktion ist nur dann möglich, wenn die gesamte Veränderung der freien Energie der Gibbs negativ ist, wenn sie gleich Null ist, wird angenommen, dass die chemische Reaktion im Gleichgewicht ist. Für Elektronen, Atome und Moleküle gibt es nur begrenzte Staaten an Energie. Diese werden durch die Regeln der Quantenmechanik bestimmt, die die Quantisierung der Energie eines gebundenen Systems erfordern. Die Atome/Moleküle in einem höheren Energie-Staat sollen aufgeregt sein. Die Moleküle/Atome der Substanz in einem angeregten Energie-Staat sind oft viel reaktiver; das heißt, besser gegen chemische Reaktionen geeignet ist. Die Phase eines Stoffes wird unweigerlich durch seine Energie und die Energie seiner Umgebung bestimmt. Wenn die intermolekularen Kräfte eines Stoffes so sind, dass die Energie der Umgebung nicht ausreicht, um sie zu überwinden, tritt sie wie bei Wasser (H2O) in einer geordneteren Phase wie flüssig oder fest auf. eine Flüssigkeit bei Raumtemperatur, weil ihre Moleküle durch Wasserstoffbrücken gebunden sind.[43] Während Schwefelwasserstoff (H2S) ein Gas bei Raumtemperatur und Standarddruck ist, da seine Moleküle durch schwächere Dipol-Dipol-Interaktionen gebunden sind. Die Energieübertragung von einer chemischen Substanz auf eine andere hängt von der Energiemenge ab, die von einer Substanz emittiert wird. Allerdings wird die Wärmeenergie häufig leichter von fast jeder Substanz auf eine andere übertragen, weil die Phononen, die für den Schwingungs- und Rotationsenergiegrad in einer Substanz verantwortlich sind, viel weniger Energie haben als Fotonen, die für den elektronischen Energietransfer herangezogen werden. Da die Schwingungen und die Rotationsenergiespiegel enger voneinander abweichen als die der elektronischen Energie, wird die Wärme leichter zwischen den Substanzen im Verhältnis zu Licht oder anderen Formen elektronischer Energie übertragen. So wird beispielsweise die ultraviolette elektromagnetische Strahlung nicht so stark von einer Substanz auf eine andere übertragen wie thermische oder elektrische Energie. Das Vorhandensein charakteristischer Energiewerte für verschiedene chemische Stoffe ist für ihre Identifizierung durch die Analyse von Spektrallinien nützlich. In der chemischen Spektroskopie werden häufig verschiedene Spektren verwendet, z. B. IR, Mikrowelle, NMR, ESR usw. Die Spektroskopie dient auch dazu, die Zusammensetzung abgelegener Objekte - wie Sterne und entfernte Galaxien - durch Analyse ihrer Strahlenspektren zu identifizieren. Der Begriff "chemische Energie" wird häufig verwendet, um das Potenzial eines chemischen Stoffes, sich einer Umwandlung durch eine chemische Reaktion zu unterziehen, oder um andere chemische Stoffe zu verwandeln.
Automatische Übersetzung
Kundenrezensionen
4.8 von 5 Sternen Bewertung6 Bewertungen insgesamt
6 Bewertungen
Bewertungen für ähnliche Produkte
5 von 5 Sternen Bewertung
Von G.16. Februar 2023 • Geprüfter Kauf
Postkarte, Größe: Standard Postkarte, Papier: Signature-Matt, Umschläge: Keine
Bewertungsprogramm bei Zazzle
Sehr schönes Motiv! Passte wunderbar zum Geschenk! Ausgesprochen sehr gut!
4 von 5 Sternen Bewertung
Von Weigant G.12. November 2021 • Geprüfter Kauf
Postkarte, Größe: Standard Postkarte, Papier: Signature-Matt, Umschläge: Keine
Bewertungsprogramm bei Zazzle
Gute Qualität! Schön gemacht! Supet. Tolles Design! Wirklich sehr schön
5 von 5 Sternen Bewertung
Von eva s.21. Februar 2012 • Geprüfter Kauf
Postkarte, Größe: Standard Postkarte, Papier: Signature-Matt, Umschläge: Keine
Bewertungsprogramm bei Zazzle
geschmackvoll, schöne fotokunstkarte, feine Nebelstimmung. Druck und Bearbeitungsmöglichkeiten, Beschriftung etc. sehr gut
zazzle-logo sollte kleiner sein, nimmt zuviel platz weg
Tags
Andere Informationen
Produkt-ID: 239858535500195548
Hergestellt am 10.4.2012, 14:02
G
Zuletzt angesehene Produkte